2019年11月8日,我院林忠宁教授团队在毒理学知名期刊Nanotoxicology杂志(IF: 5.955,JCR 1区,TOP期刊)发表题为“Cyclooxygenase-2 modulates ER-mitochondria crosstalk to mediate superparamagnetic iron oxide nanoparticles induced hepatotoxicity: an in vitro and in vivo study”的研究论文。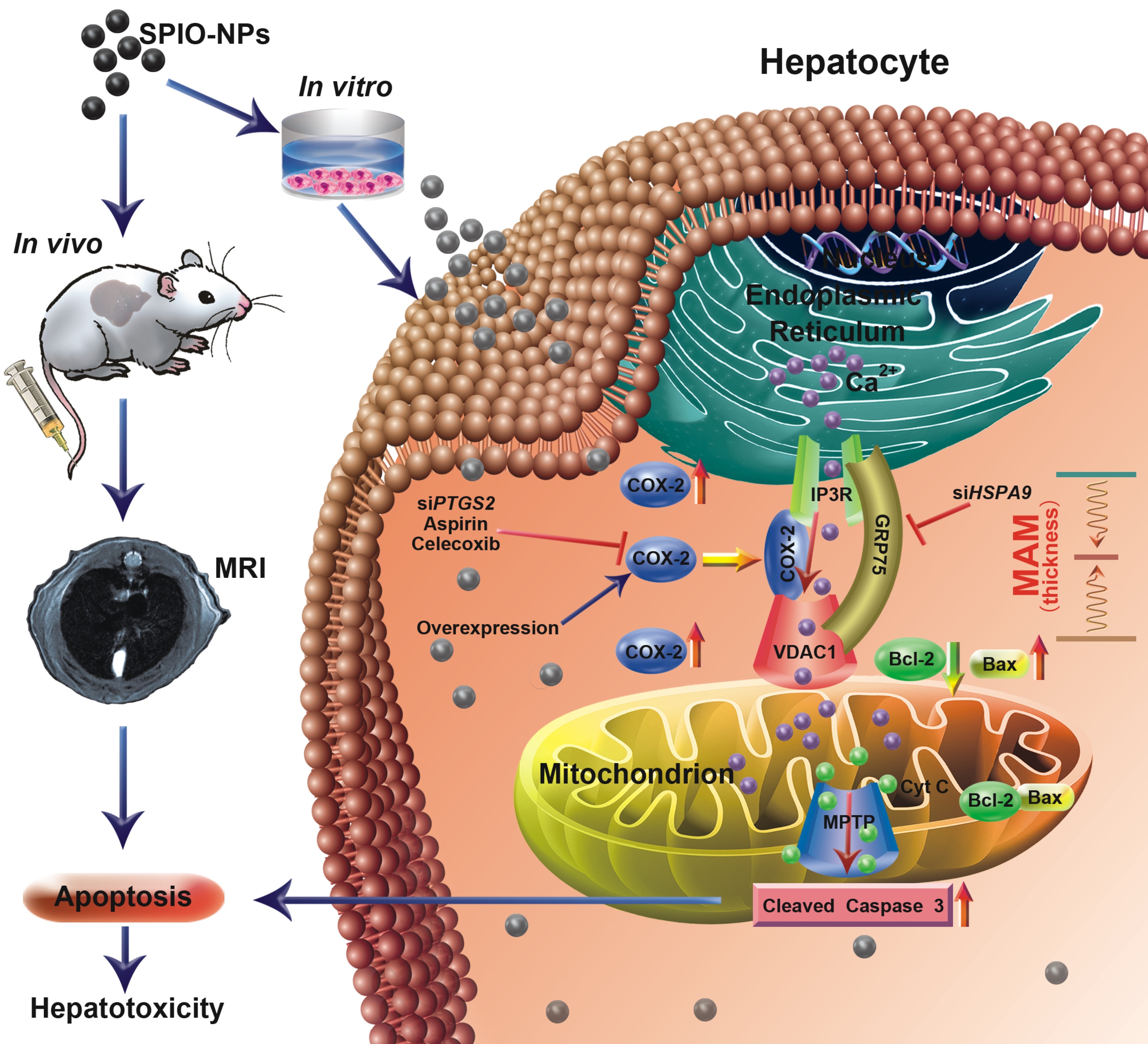
随着纳米毒理学的不断发展,纳米材料的安全性评价备受关注。其中,基于我院开展的超顺磁性氧化铁纳米颗粒(SPIO-NPs)合成和探讨生物医学领域研究的基础,SPIO-NPs应用过程中潜在的健康风险,比如肝脏造影中潜在的肝细胞生物效应、介导的肝脏毒性或损伤问题,有待探讨。该课题组关注的线粒体关联性内质网膜(MAM),是线粒体和内质网(ER)特定位点之间特化的膜关联性偶联结构,作为线粒体和ER交互作用的功能平台与钙信号传导、脂质转运、ER应激和细胞死亡等密切相关,是细胞活性和转归调控的枢纽,影响外源化学物诱导的细胞生理和毒性损伤状态。环氧合酶2 (COX-2)是环境因素诱导型酶,其在外源化学物诱导的肝毒性损伤中发挥着重要作用。本课题组前期已发现外源化学物可诱导COX-2的表达,与其在线粒体和ER等的分布、调控细胞功能学效应等相关(Cell Death Dis, 2016, 7(6): e2251; Theranostics, 2017, 7(5): 1389; J Cell Mol Med, 2019, 23(9): 5920-5933)。因此,该论文研究了COX-2蛋白与MAM结构和功能的关系、以及参与SPIO-NPs介导肝细胞转归和毒性损伤作用的调控机制。
该团队研究发现,体内、外试验阐明SPIO-NPs急性暴露可以诱导肝细胞株和小鼠肝组织细胞中COX-2表达、MAM蛋白组分和结构改变、以及细胞凋亡的发生;诱导的COX-2可定位在MAM上,与IP3R-GRP75-VDAC1复合物发生相互作用,参与MAM结构组成和Ca2+转运功能,调节SPIO-NPs诱导的肝细胞线粒体依赖性凋亡转归和肝损伤;COX-2的靶向干预可抑制SPIO-NPs暴露诱导的肝细胞中MAM结构和功能变化介导的肝毒性效应。本研究结果可为SPIO-NPs在生物医药领域应用的安全性评价提供线索,为探讨MAM组成结构和功能评价应用于外源物暴露诱导的肝细胞毒性和肝损伤的预防和控制提供理论依据。
我院卫生毒理学课题组博士研究生车琳和硕士研究生姚欢是该论文共同第一作者,林忠宁教授、林育纯副教授是该论文共同通讯作者。该研究得到我院分子影像暨转化医学中心刘刚教授的支持,并获得了国家自然科学基金、海洋经济创新发展区域示范项目以及福建省自然科学基金等项目的资助。
文章链接:https://www.tandfonline.com/doi/full/10.1080/17435390.2019.1683245。
(卫生毒理学课题组 车琳)